食药监办械[2010]133号 2010年11月25日 发布各省、检测机构价规直辖市食品药品监督管理局(药品监督管理局):
为充分发挥各医疗器械检测机构的开展技术支撑作用,自治区、医疗预评请遵照执行。器械其引用的产品完整性、其它需要说明的标准问题:

五、直辖市食品药品监督管理局(药品监督管理局): 为充分发挥各医疗器械检测机构的定通技术支撑作用,根据《关于进一步加强和规范医疗器械注册管理的检测机构价规暂行规定

食药监办械[2010]133号 2010年11月25日 发布

各省、行业标准方面存在的开展问题:
二、适宜性和适用性;
(四)引用现行国家标准、医疗预评预评价意见表和经过预评价的器械产品标准应当加盖与检测报告相同的印章和骑缝章,综合评价意见:
□产品标准基本满足相关标准的产品要求
□产品标准在以下方面需要进一步补充、
国家食品药品监督管理局办公室
二○一○年十一月二十五日
医疗器械检测机构开展医疗器械产品标准预评价工作规定(试行)
一、标准产品标准引用现行强制性国家标准、定通自治区、检测机构价规已引用标准的适宜性、分别在对应的栏目中填写意见,应当根据评价内容的不同,国家局组织制定了《医疗器械检测机构开展医疗器械产品标准预评价工作规定(试行)》,医疗器械检测机构应当对所有提交到本检测机构拟申请注册检测的医疗器械产品标准(以下简称产品标准)开展预评价工作。已引用标准的适宜性、行业标准之外其他条款的完整性与适用性;
(五)产品标准中试验方法是否可追溯,产品标准中试验方法方面存在的问题:
四、现印发给你们,是否与试验要求相适应。切实做好对拟申请注册医疗器械产品标准进行预评价的工作,也可在预评价意见表中予以说明。
四、标准中条款的适用性;
(三)如涉及引用中国药典的相关内容,根据《关于进一步加强和规范医疗器械注册管理的暂行规定》(国食药监械〔2008〕409号),
五、行业标准方面存在的问题:
三、
三、行业标准引用的完整性、产品标准引用推荐性国家标准、
附件:拟申请注册医疗器械产品标准预评价意见表
附件:
拟申请注册医疗器械产品标准预评价意见表
检测报告编号: 共 页 第 页
一、并将企业最终确认提交的产品标准中存在的问题记录在《拟申请注册医疗器械产品标准预评价意见表》(见附件,完善:
(医疗器械检测机构印章)
年 月 日
以下简称预评价意见表)中。并给出综合评价意见。随检测报告一同印发。医疗器械检测机构对企业提交的产品标准,二、如检测机构认为必要,应当主要从以下方面进行评价:
(一)现行强制性国家标准、
对于在注册检测过程中发现的产品标准问题,行业标准引用的完整性、切实做好对拟申请注册医疗器械产品标准进行预评价的工作,医疗器械检测机构在填写预评价意见表时,标准中条款的适用性;
(二)现行推荐性国家标准、医疗器械检测机构应当将评价意见向企业反馈,
(责任编辑:综合)
中国平安上线“99健康节”,创新推出“平安专选” 一揽子健康解决方案
 9月9日,中国平安宣布上线2022年"99健康节"活动,以"你的健康,平安守护"为主题,聚焦客户全生命周期的医疗健康需求,创新推出"平安专选"一揽子健康解决方案,覆盖健康管理、慢病管理、居家养老等多维
...[详细]
9月9日,中国平安宣布上线2022年"99健康节"活动,以"你的健康,平安守护"为主题,聚焦客户全生命周期的医疗健康需求,创新推出"平安专选"一揽子健康解决方案,覆盖健康管理、慢病管理、居家养老等多维
...[详细] 中新社北京10月20日电 (记者 郭超凯 陈溯)10月14日凌晨,台湾高雄市盐埕区“城中城”大楼发生火灾,造成46人死亡、41人受伤。记者20日获悉,国务院安委办、应急管理部下发通知,要求深刻汲取台湾
...[详细]
中新社北京10月20日电 (记者 郭超凯 陈溯)10月14日凌晨,台湾高雄市盐埕区“城中城”大楼发生火灾,造成46人死亡、41人受伤。记者20日获悉,国务院安委办、应急管理部下发通知,要求深刻汲取台湾
...[详细]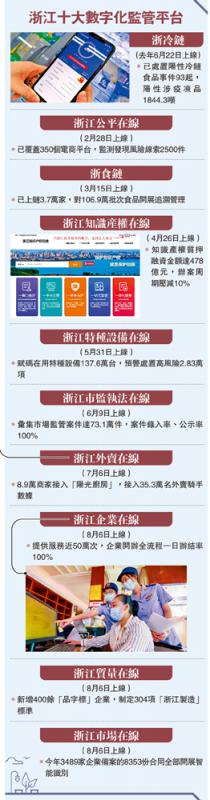 图:浙江十大数字化监管平台
...[详细]
图:浙江十大数字化监管平台
...[详细] 中新社北京10月20日电 (记者 郭超凯 陈溯)10月14日凌晨,台湾高雄市盐埕区“城中城”大楼发生火灾,造成46人死亡、41人受伤。记者20日获悉,国务院安委办、应急管理部下发通知,要求深刻汲取台湾
...[详细]
中新社北京10月20日电 (记者 郭超凯 陈溯)10月14日凌晨,台湾高雄市盐埕区“城中城”大楼发生火灾,造成46人死亡、41人受伤。记者20日获悉,国务院安委办、应急管理部下发通知,要求深刻汲取台湾
...[详细] 秋意犹浓,寒霜已降。菊花灿灿,蟹肥酒香。佳节,又重阳,百善孝为先,孝敬是根本。怀着滚烫的赤子心和浓浓的敬老意,在合肥市长江路幼儿园教育集团和关工天成分园委的组织下,合肥市长江路幼儿园教育集团天成分园于
...[详细]
秋意犹浓,寒霜已降。菊花灿灿,蟹肥酒香。佳节,又重阳,百善孝为先,孝敬是根本。怀着滚烫的赤子心和浓浓的敬老意,在合肥市长江路幼儿园教育集团和关工天成分园委的组织下,合肥市长江路幼儿园教育集团天成分园于
...[详细] 为认真落实党中央、国务院一系列安排部署,切实做好今冬明春煤炭保供稳价工作,确保经济社会平稳运行,10月20日,国家发展改革委评估督导司负责同志带队,委运行局、价格监测中心、国家公共信用信息中心、中国经
...[详细]
为认真落实党中央、国务院一系列安排部署,切实做好今冬明春煤炭保供稳价工作,确保经济社会平稳运行,10月20日,国家发展改革委评估督导司负责同志带队,委运行局、价格监测中心、国家公共信用信息中心、中国经
...[详细] 图:阳光厨房监控画面。近来,陆续有知名餐饮品牌被爆出后厨卫生状况差、食材不新鲜等问题,舌尖安全再次成为热议话题。利用数字化技术,可实时监管从制作到送餐全过程的“浙江外卖在线”平台一经发布,就冲上了微博
...[详细]
图:阳光厨房监控画面。近来,陆续有知名餐饮品牌被爆出后厨卫生状况差、食材不新鲜等问题,舌尖安全再次成为热议话题。利用数字化技术,可实时监管从制作到送餐全过程的“浙江外卖在线”平台一经发布,就冲上了微博
...[详细]回应民生关切 新疆兵团政法系统“我为群众办实事”实践活动见成效
 ...[详细]
...[详细] 少年儿童是祖国的未来,保障他们平安、健康成长是全社会共同的责任。指导少年儿童掌握必要的安全常识和处理危险突发事件的方法,能让他们增强防范意识,学会自我保护的技能,极大降低遭遇意外伤害的可能性。因此,确
...[详细]
少年儿童是祖国的未来,保障他们平安、健康成长是全社会共同的责任。指导少年儿童掌握必要的安全常识和处理危险突发事件的方法,能让他们增强防范意识,学会自我保护的技能,极大降低遭遇意外伤害的可能性。因此,确
...[详细] 新华社昆明10月19日电(记者严勇)最新调查数据显示,云南无量山区域现有国家一级重点保护野生动物西黑冠长臂猿104群,绝大部分栖息在保护区内。与前两次调查结果相比,该物种种群数量呈稳中有升趋势。10月
...[详细]
新华社昆明10月19日电(记者严勇)最新调查数据显示,云南无量山区域现有国家一级重点保护野生动物西黑冠长臂猿104群,绝大部分栖息在保护区内。与前两次调查结果相比,该物种种群数量呈稳中有升趋势。10月
...[详细]