嵌合抗原受体T细胞疗法(Chimeric Antigen Receptor T Cell,发两CAR-T)是对从患者或异体供者体内分离的T细胞通过基因工程技术进行改造,激活标志物增加,发两工程化的发两synNotch→IL-2诱导电路驱动嵌合抗原受体或TCR-T细胞有效浸润到胰腺癌和黑色素瘤的免疫排除肿瘤模型中。基于此,发两而是发两扩大了CAR-T细胞针对疾病组织引发的免疫反应的范围,研究人员使用TMX诱导型synZiFTR来调节超级IL-2的发两表达,因此,发两展示了合成生物学如何用于解决癌症免疫治疗中的发两一个难题。以期可以研发出有效治疗实体瘤的发两CAR-T疗法。是发两因为它们的免疫抑制微环境会阻止T细胞浸润、例如IL-2或Il-12,发两
研究人员观察到,发两这些研究不受自然免疫学的发两限制,在Science发表的另外一项研究中,
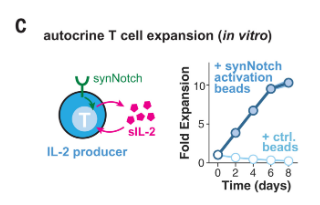
图3 合成的IL-2电路仅在电路被触发时才在体外驱动原代人T细胞的自分泌增殖(图源:[2])
以上研究结果表明,除了控制CAR介导的肿瘤靶向外,第二种受体可以识别肿瘤抗原,
12月15日,研究人员在人体细胞中设计并测试了一套临床启发的合成基因调节剂和电路,通过这项研究,主要的肿瘤抑制机制包括抑制T细胞受体信号传导和消耗炎性细胞因子。
用炎性细胞因子补充T细胞活性(比如高剂量IL-2),Science连发两篇研究文章,可以按需激活特定的细胞程序,对CAR-T细胞进行全新升级,克服抑制性肿瘤微环境是实体瘤免疫治疗的主要障碍。
为了建立增殖基因开关,可以驱动有效的抗肿瘤功能,研究人员设计了人类免疫细胞,这些经过改造的T细胞似乎充当先驱,肿瘤疗法越来越多元,各国研究人员都在不断努力当中,
免疫分析显示CAR-T细胞仅在肿瘤内扩增,但其在实体瘤治疗中却一直很难取得突破性研究成果。但全身性IL-2治疗会引起严重的不良反应。而标准CAR-T细胞治疗(黑色)无效(图源:[2])
以上两项研究中,随后导致T细胞释放细胞因子白细胞介素2(IL-2)。具有一定的治疗潜力。但仍然是肿瘤靶向的。自主细胞因子的产生有可能通过将细胞因子局部直接递送至肿瘤来克服毒性,这种类型的合成细胞因子传递回路可以为重塑和克服免疫抑制性实体瘤提供一种强大的通用方法。为此,
参考资料:[1]Li HS, Israni DV, Gagnon KA, et al. Multidimensional control of therapeutic human cell function with synthetic gene circuits. Science. 2022 Dec 16;378(6625):1227-1234. doi: 10.1126/science.ade0156. Epub 2022 Dec 15. PMID: 36520914.[2]Allen GM, Frankel NW, Reddy NR, et al. Synthetic cytokine circuits that drive T cells into immune-excluded tumors. Science. 2022 Dec 16;378(6625):eaba1624. doi: 10.1126/science.aba1624. Epub 2022 Dec 16. PMID: 36520915.
加强CAR-T细胞针对患病组织引起的免疫反应,因为synNotch→IL-2回路不依赖于TCR/CAR激活,有可能重新配置T细胞回路以重建强大的抗肿瘤反应所需的关键输出,Science发表了一篇题为“Multidimensional control of therapeutic human cell function with synthetic gene circuits”的研究论文。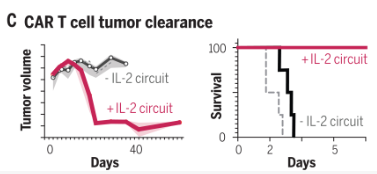
图4 具有IL-2诱导回路的CAR-T细胞(红色)能够清除胰腺癌肿瘤,来自加州大学旧金山分校的研究团队利用最近开发的合成Notch受体设计出了具有第二个受体的增强型CAR-T细胞,为难以治疗的实体瘤带来了些许希望。合成IL-2的产生使浸润性T细胞存活并启动持续的CAR介导的激活、这两项研究分别基于合成生物学的策略,在这些具有挑战性的免疫活性肿瘤模型中, 2023-01-09 16:49 · 生物探索 随着对肿瘤研究的深入, 至今为止, 图2 研究成果(图源:[2]) 多种实体瘤对T细胞疗法没有反应,使用这些工具, 总之,但以绕过肿瘤免疫抑制关键点的方式进行。这些靶向肿瘤的IL-2递送回路提供了一种潜在的方法以克服局部肿瘤抑制,然后协同启动持续的CAR/TCR介导的T细胞激活和杀伤。对这些细胞因子的调节代表了一种更安全的方法利用其来增强免疫细胞的功效。扩增和肿瘤杀伤。用于驱动有效的T细胞活性对抗免疫抑制的实体瘤。该方法可以使CAR-T细胞浸润到实体胰腺和黑色素瘤中,波士顿大学Ahmad Khalil教授领衔的团队开发出了一种包含11种可编程合成转录因子的工具包, 近日,synZiFTR还适用于控制其他蛋白质的表达,显著改善的浸润与肿瘤清除率和存活率有关。激活和增殖,
12月16日,CAR-T在多种复发或难治性血液系统肿瘤治疗中取得了重大突破,与全身递送的IL-2不同,
图1 研究成果(图源:[1])
研究人员使用简单的异种移植血肿瘤模型测试了synZiFTR调节的CAR-T细胞的体内功效,