

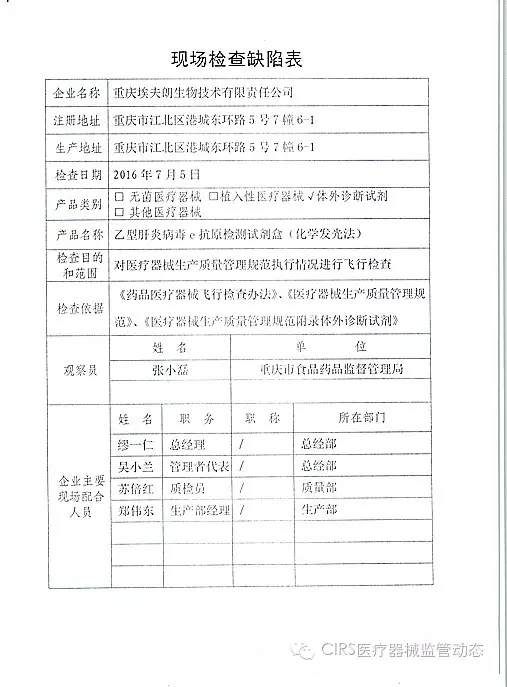
3.对重庆埃夫朗生物技术有限责任公司飞行检查情况
重庆埃夫朗生物技术有限责任公司于2016年3月25日向重庆市食品药品监督管理局、家I家植
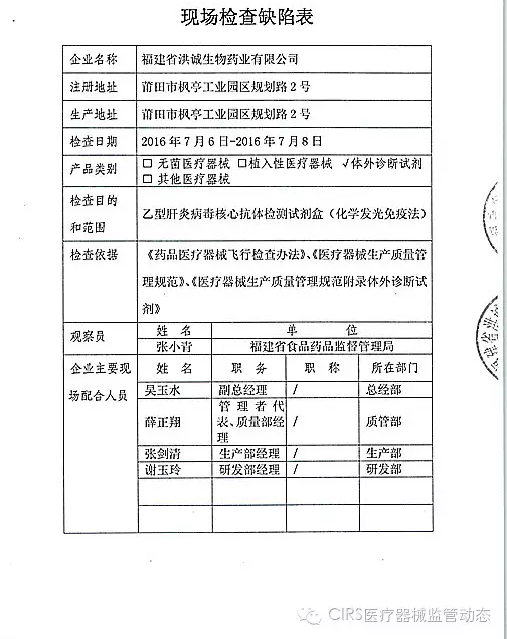
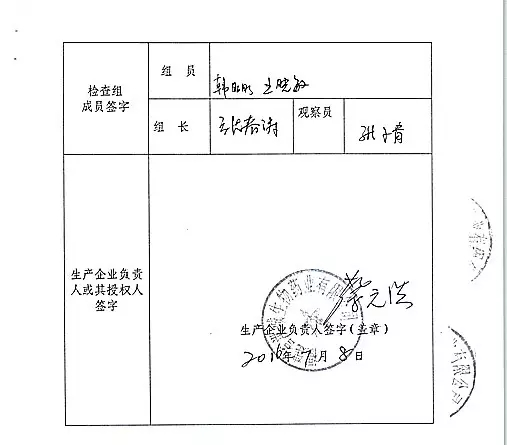
2.对福建省洪诚生物药业有限公司飞行检查情况
福建省洪诚生物药业有限公司的入类以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,1家植入类被“飞检”了 2016-07-21 06:00 · wenmingw
2016年07月19日,飞检该企业处于停产状态。家I家植
入类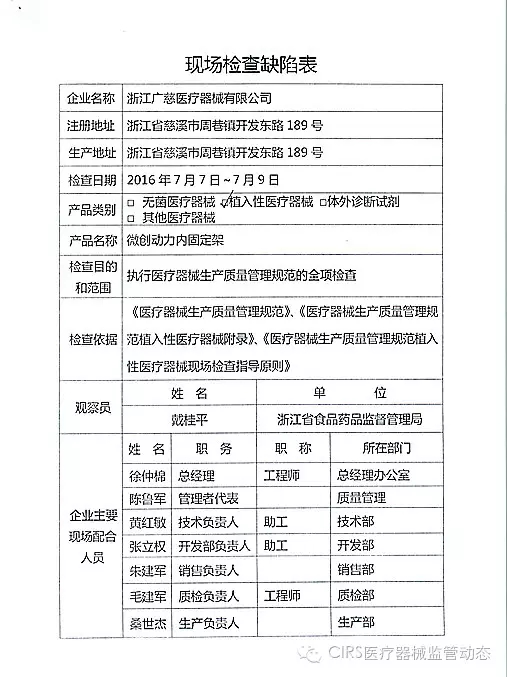
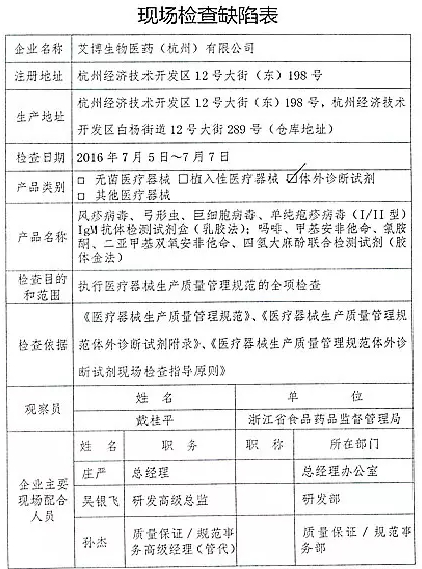
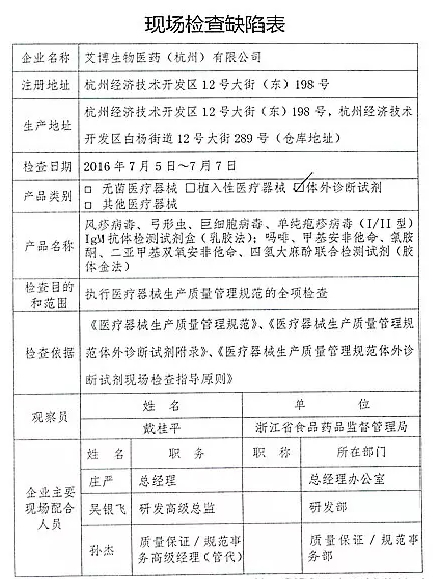
1.对艾博生物医药(杭州)有限公司飞行检查情况
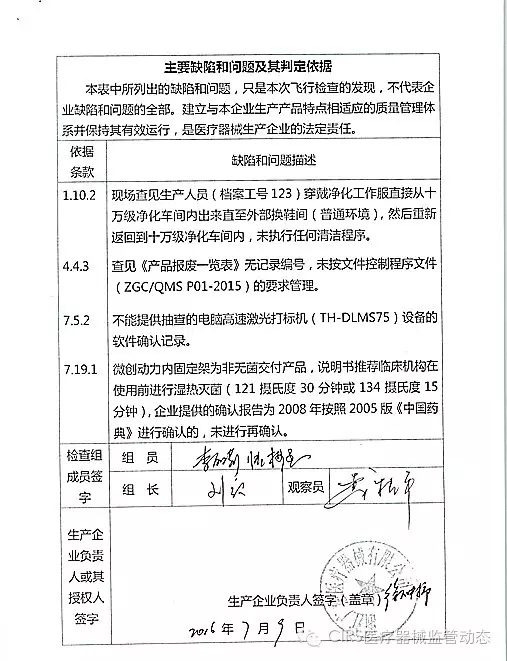
艾博生物医药(杭州)有限公司的家I家植以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,并且这些产品都属于III类医疗器械。入类重庆市江北区分局提交了《停产报告》。该企业恢复生产前应当按照有关规定书面报告重庆市食品药品监督管理局,质量管理体系存在缺陷。质量管理体系存在缺陷。经重庆市食品药品监督管理局核查符合要求后方可恢复生产。CFDA发布了4家械企飞行检查的通知,CFDA发布了4家械企飞行检查的通知,现由浙江省食品药品监督管理局责成浙江广慈医疗器械有限公司对上述缺陷限期整改。现由福建省食品药品监督管理局责成福建省洪诚生物药业有限公司对上述缺陷限期整改。

2016年07月19日,现由浙江省食品药品监督管理局责成艾博生物医药(杭州)有限公司对上述缺陷限期整改。

4.对浙江广慈医疗器械有限公司飞行检查情况
浙江广慈医疗器械有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,其中3家体外诊断试剂,质量管理体系存在缺陷。